查驗中心以促進產業發展、增加國際競爭優勢及建立諮詢服務之品質、透明化及一致性為目的,於2018年1月1日起推出「付費諮詢服務」方案,明訂諮詢服務項目包含三大項目:
1.臨床試驗申請案預審(IND Prior Assessment):包含臨床試驗新案或申覆案,依申請者須要,分為品質部分,非臨床部分,或完整技術性資料之事先評估。
2.臨床試驗諮詢(Clinical Trial Consultation):包含第一期至第四期臨床試驗設計相關諮詢。
3.研發策略諮詢(Regulatory consultation services):包含銜接性試驗策略評估、查驗登記策略評估、其他計畫書諮詢等項目。
申請者可在藥品開發期間、申請臨床試驗前及申請銜接性試驗評估/查驗登記前等各種時程,依據需求提出諮詢服務申請。諮詢流程包含:申請者線上填寫申請表、策略商談、查驗中心受理後成立諮詢團隊提供深入之法規科學建議、以書面意見及諮詢會議形式回覆申請者。申請者須於正式送件時一併檢附該書面意見及會議紀錄,作為查驗中心日後審查之重要參考依據。
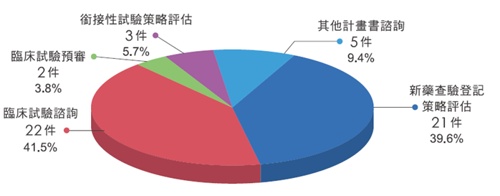
2022年藥品付費諮詢案件結案計有53件。以案件類別區分,新藥查驗登記策略評估21件,臨床試驗諮詢22件,臨床試驗預審2件,銜接性試驗策略評估3件,其他計畫書諮詢5件。案件數及所占百分比如下圖。
查驗中心自2005年起建立指標案件諮詢輔導服務機制,組成專屬諮詢輔導團隊,提供國內生技製藥與學研機構在醫藥品研發各階段之法規科學建議,期望藉由主動式的深入諮詢輔導,降低醫藥品研發成本,縮短研發時程。
指標案件輔導對象涵蓋國產廠商、生技公司、學術與研究機構,早期是由查驗中心向國內產學研單位以定期主動徵求、公開甄選方式進行。自2012年起,則改成隨到隨評的方式,將申請案依創新程度、貢獻程度、早收程度、滿足法規程度等四面向進行評估及篩選。評選後獲同意列入指標案者,由查驗中心與申請方正式簽約,並由輔導團隊與申請方共同確立年度預定目標、訂定案件之各階段性目標,召開諮詢輔導會議,主動掌握專案研發進度。查驗中心針對指標案件之諮詢輔導建置有主動積極輔導機制,提供不同研發期程之國內外專業法規參考資訊,與全方位的法規諮詢服務,期能協助國內醫藥產業發展並促成成功案例。
1. 案件分析
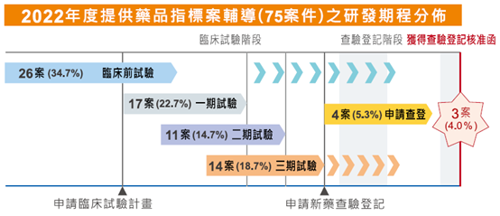
2022年間持續輔導的藥品指標案件總計75件,其中有14件為2022年新增指標案。2022年提供法規科學諮詢的次數總計有32件次。
以藥品研發期程分類,於臨床前階段有26件,在一期臨床試驗階段17件,在二期臨床試驗階段11件,在三期臨床試驗階段14件,申請查驗登記階段4件,查驗登記核准函3件。
2.藥品指標案件法規科學諮詢輔導主要成果
為呈現藥品指標案件之輔導成果,依藥品開發歷程設定以下五個輔導成果里程碑:通過臨床試驗申請案進入一期臨床試驗、通過臨床試驗申請案進入二期臨床試驗案、通過臨床試驗申請案進入三期臨床試驗、申請新藥查驗登記、及獲得查驗登記核准函。
2022年度成功達成上述里程碑者計有11件:獲得一期臨床試驗核准3件,獲得二期臨床試驗核准5件,獲得三期臨床試驗核准1件,申請新藥查驗登記1件及獲得查驗登記核准函1件。
歷年成果詳如年報所示:連結至年報頁面
申請者可依據產品研發期程、案件屬性和法規需求提出諮詢。查驗中心就申請者提出的諮詢議題和相關技術性資料,進行專案研究,以書面/諮詢會議等方式,提供不同研發階段之法規需求及試驗設計相關建議,以作為研發策略規劃之參考。
2022 年查驗中心完成藥品法規諮詢案共計505件。以藥品類別區分,依諮詢藥品類別分析,計有化學藥品408件,生物藥品71件,基因/細胞治療製劑22件,植物新藥3件,複合性藥物1件。
歷年成果詳如年報所示:連結至年報頁面
2022 年查驗中心完成藥品法規諮詢案
查驗中心於2022年執行轉譯臨床主軸-藥品與醫療器材研發法規諮詢與輔導評估業務,共進行藥品類案件13件,其中包括計畫審查12件及計畫進度評估1件。
經濟部科專計畫之法規科學評估計畫審查(包含構想書審查,快速審查及計畫書審查)共完成52件,其中業界科專30件、法人科專17件、學界科專5件。
經濟部科專計畫之法規科學評估進度審查(包含期中查證、期末查證及全程查證)共完成63件,其中業界科專32件、法人科專29件、學界科專2件。
歷年成果詳如年報所示:連結至年報頁面